Biografi niels bohr 1885 1962 – Di jantung Eropa, di tengah hiruk pikuk Copenhagen, seorang anak laki-laki bernama Niels Bohr lahir pada tahun 1885. Di tengah keluarga yang sarat dengan intelektualitas, Niels tumbuh dengan rasa haus akan pengetahuan yang tak terpadamkan. Ketertarikannya pada alam semesta, khususnya fisika, membara seperti api unggun yang menerangi jalannya menuju penemuan-penemuan revolusioner. Kisah Niels Bohr bukan sekadar perjalanan seorang ilmuwan jenius, melainkan sebuah epik tentang tekad, keingintahuan, dan dedikasi untuk mengungkap rahasia alam.
Dari bangku sekolah di Denmark hingga panggung dunia fisika, Niels Bohr menjelma menjadi tokoh kunci dalam revolusi ilmiah abad ke-20. Model atomnya, yang mendobrak dogma ilmiah saat itu, membuka pintu gerbang menuju pemahaman baru tentang struktur atom dan melahirkan era baru dalam fisika. Kontribusinya dalam pengembangan mekanika kuantum, teori atom, dan fisika nuklir mengukuhkan namanya sebagai salah satu fisikawan paling berpengaruh sepanjang masa.
Kehidupan Awal Niels Bohr

Niels Bohr, fisikawan jenius yang mengubah pemahaman kita tentang atom, lahir pada 7 Oktober 1885, di Copenhagen, Denmark. Masa kecilnya diwarnai oleh suasana intelektual yang hangat, di mana sains dan filsafat menjadi perbincangan hangat di meja makan. Ayahnya, Christian Bohr, seorang profesor fisiologi terkemuka, dan ibunya, Ellen Adler Bohr, seorang wanita yang cerdas dan berbudaya, menanamkan nilai-nilai keingintahuan dan kecerdasan pada Niels sejak kecil.
Pendidikan Awal Niels Bohr
Niels Bohr menempuh pendidikan di Gammelholm Latin School, sebuah sekolah menengah terkenal di Copenhagen. Di sekolah ini, ia menunjukkan bakat luar biasa dalam matematika dan fisika, dan mulai menunjukkan minat yang mendalam pada ilmu pengetahuan. Ia juga aktif dalam olahraga, terutama sepak bola, dan bahkan pernah menjadi kapten tim sepak bola sekolahnya.
Pengaruh Keluarga dan Lingkungan, Biografi niels bohr 1885 1962
Lingkungan keluarga Bohr yang kaya akan intelektualitas dan budaya sangat berpengaruh pada minat Niels di bidang fisika. Ayahnya, Christian Bohr, seringkali membahas topik-topik ilmiah dengan Niels dan saudara lelakinya, Harald. Christian Bohr adalah seorang profesor fisiologi terkemuka, yang terkenal dengan penelitiannya tentang respirasi. Ia juga merupakan seorang ilmuwan yang memiliki minat yang luas, termasuk filsafat dan seni.
Di rumah, Niels Bohr dikelilingi oleh buku-buku ilmiah dan karya seni. Ia seringkali menghabiskan waktu di perpustakaan pribadi ayahnya, membaca karya-karya ilmiah terkemuka. Suasana ini membantunya mengembangkan rasa ingin tahu yang besar dan mendorongnya untuk mempelajari lebih dalam tentang alam semesta.
Pencapaian Akademis di Universitas Copenhagen
Pada tahun 1903, Niels Bohr memasuki Universitas Copenhagen untuk mempelajari fisika. Di universitas ini, ia belajar di bawah bimbingan fisikawan terkemuka seperti Christian Christiansen dan C.F.E. Holm. Ia juga aktif dalam penelitian ilmiah dan menerbitkan makalah pertamanya tentang teori elektron pada tahun 1906.
| Tahun | Pencapaian Akademis |
|---|---|
| 1903 | Memasuki Universitas Copenhagen untuk mempelajari fisika. |
| 1906 | Menerbitkan makalah pertamanya tentang teori elektron. |
| 1911 | Menerima gelar doktor dengan tesis tentang teori elektron dalam logam. |
Kontribusi Bohr dalam Pengembangan Model Atom
Pada tahun 1911, Niels Bohr menerima gelar doktor dengan tesis tentang teori elektron dalam logam. Setelah menyelesaikan studinya, ia pindah ke Inggris untuk bekerja dengan fisikawan terkemuka J.J. Thomson di Universitas Cambridge dan Ernest Rutherford di Universitas Manchester. Di Manchester, Bohr terinspirasi oleh model atom Rutherford, yang menggambarkan atom sebagai inti positif yang dikelilingi oleh elektron negatif.
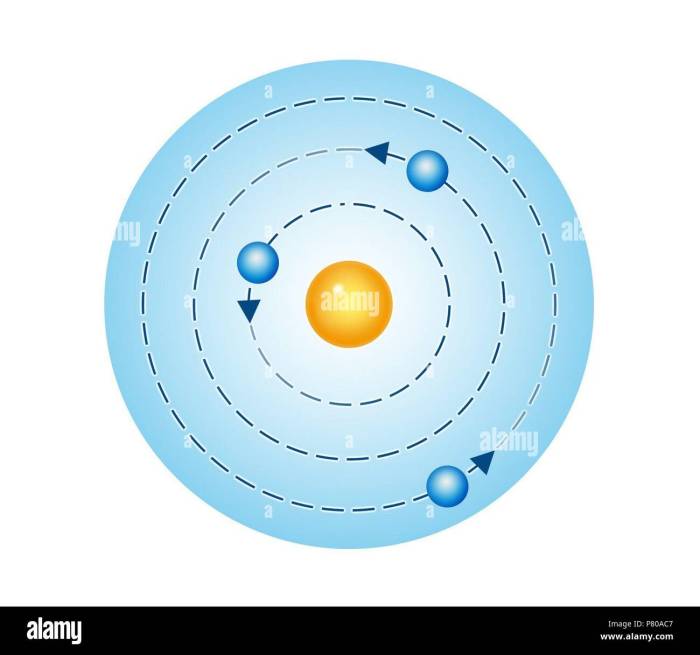
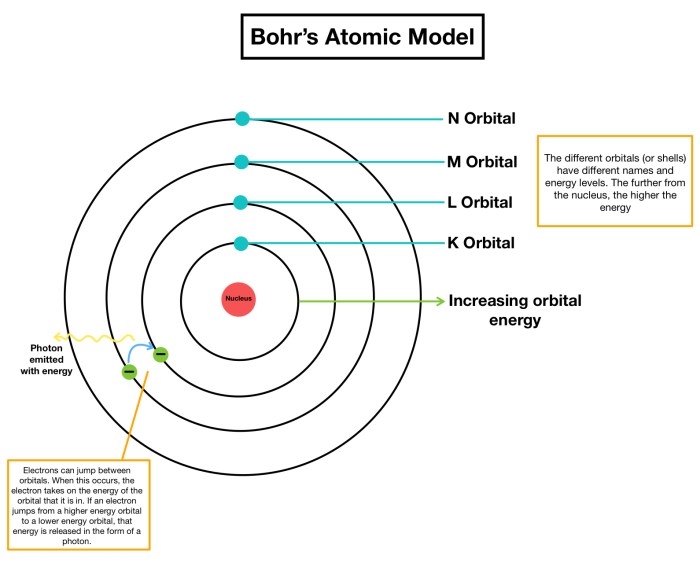
Bohr menyadari bahwa model Rutherford tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom. Ia kemudian mengembangkan model atomnya sendiri, yang menggabungkan ide-ide dari teori kuantum Max Planck. Dalam model atom Bohr, elektron hanya dapat berada pada orbit tertentu dengan energi tertentu, dan elektron dapat melompat dari satu orbit ke orbit lainnya dengan menyerap atau memancarkan energi.
Model atom Bohr merupakan tonggak sejarah dalam fisika atom, karena berhasil menjelaskan spektrum atom hidrogen dan fenomena lain yang tidak dapat dijelaskan oleh model sebelumnya. Model ini juga menjadi dasar untuk pengembangan teori atom modern.
Model Atom Bohr

Model atom Bohr, yang diajukan oleh fisikawan Denmark Niels Bohr pada tahun 1913, adalah sebuah lompatan besar dalam pemahaman kita tentang struktur atom. Sebelum Bohr, model atom Rutherford, yang menggambarkan atom sebagai inti positif yang dikelilingi oleh elektron negatif, gagal menjelaskan mengapa elektron tidak jatuh ke dalam inti akibat gaya tarik elektrostatis. Bohr, melalui intuisi dan pengetahuannya tentang spektrum cahaya, berhasil mengatasi kelemahan ini dengan menggabungkan ide-ide dari fisika klasik dan teori kuantum.
Asumsi dan Implikasi Model Atom Bohr
Model atom Bohr dibangun di atas beberapa asumsi kunci, yang membawa implikasi penting bagi pemahaman kita tentang atom:
- Elektron bergerak mengelilingi inti atom pada orbit-orbit tertentu yang disebut kulit elektron, dan hanya dapat berada pada orbit-orbit ini. Orbit ini memiliki tingkat energi tertentu, dan elektron tidak dapat berada di antara orbit-orbit tersebut.
- Elektron hanya dapat menyerap atau melepaskan energi dalam bentuk paket-paket diskrit yang disebut kuanta. Ketika elektron melompat dari orbit yang lebih tinggi ke orbit yang lebih rendah, ia melepaskan energi dalam bentuk foton cahaya. Frekuensi cahaya yang dipancarkan bergantung pada selisih energi antara kedua orbit tersebut.
- Momentum sudut elektron dalam orbitnya merupakan kelipatan bulat dari konstanta Planck yang dibagi dengan 2π. Asumsi ini membantu menjelaskan mengapa elektron tidak jatuh ke dalam inti, karena hanya orbit tertentu yang diizinkan, dan orbit tersebut memiliki momentum sudut yang terkuantisasi.
Ilustrasi Perbedaan Model Atom Bohr dan Model Sebelumnya
Untuk lebih memahami perbedaan antara model atom Bohr dan model atom sebelumnya, bayangkan sebuah planet yang mengitari matahari. Dalam model atom Rutherford, elektron-elektron seperti planet yang bebas bergerak dalam orbit elips di sekitar inti. Namun, dalam model atom Bohr, elektron-elektron hanya dapat berada pada orbit-orbit tertentu, seperti planet yang hanya dapat berada pada orbit-orbit tertentu di sekitar matahari.
Perluas pemahaman Kamu mengenai biografi mao zedong dengan resor yang kami tawarkan.
Ilustrasi ini membantu menjelaskan mengapa model atom Bohr mampu menjelaskan spektrum cahaya yang dipancarkan oleh atom, sedangkan model atom Rutherford tidak. Model atom Bohr menunjukkan bahwa elektron-elektron hanya dapat menyerap atau melepaskan energi dalam bentuk kuanta, dan kuanta ini sesuai dengan frekuensi cahaya yang dipancarkan oleh atom.
Anda juga berkesempatan memelajari dengan lebih rinci mengenai biografi ettore bugatti kisah pendiri bugatti untuk meningkatkan pemahaman di bidang biografi ettore bugatti kisah pendiri bugatti.
Mengatasi Kekurangan Model Atom Sebelumnya
Model atom Bohr berhasil mengatasi beberapa kekurangan model atom sebelumnya, seperti model atom Rutherford. Berikut beberapa contohnya:
- Model atom Bohr mampu menjelaskan spektrum cahaya yang dipancarkan oleh atom hidrogen, sedangkan model atom Rutherford tidak. Model atom Bohr menunjukkan bahwa elektron-elektron hanya dapat menyerap atau melepaskan energi dalam bentuk kuanta, dan kuanta ini sesuai dengan frekuensi cahaya yang dipancarkan oleh atom.
- Model atom Bohr mampu menjelaskan stabilitas atom, sedangkan model atom Rutherford tidak. Model atom Rutherford menyatakan bahwa elektron-elektron akan terus-menerus memancarkan energi dan jatuh ke dalam inti, tetapi model atom Bohr menunjukkan bahwa elektron-elektron hanya dapat berada pada orbit-orbit tertentu dan tidak akan jatuh ke dalam inti.
Eksperimen yang Mendukung Model Atom Bohr
Eksperimen-eksperimen yang mendukung model atom Bohr meliputi:
- Spektrum cahaya yang dipancarkan oleh atom hidrogen. Spektrum ini menunjukkan bahwa atom hidrogen hanya memancarkan cahaya pada frekuensi-frekuensi tertentu, yang sesuai dengan kuanta energi yang dilepaskan oleh elektron-elektron ketika mereka melompat dari orbit yang lebih tinggi ke orbit yang lebih rendah.
- Efek fotolistrik. Efek fotolistrik menunjukkan bahwa cahaya dapat melepaskan elektron dari permukaan logam, dan energi elektron yang dilepaskan bergantung pada frekuensi cahaya.
- Efek Compton. Efek Compton menunjukkan bahwa cahaya dapat berinteraksi dengan elektron seperti partikel, dan energi cahaya yang dilepaskan bergantung pada sudut hamburan.
Kontribusi Niels Bohr di Bidang Fisika

Niels Bohr, seorang fisikawan Denmark yang brilian, adalah salah satu tokoh kunci dalam revolusi fisika pada abad ke-20. Karyanya tidak hanya mengubah pemahaman kita tentang atom, tetapi juga membuka jalan bagi pengembangan mekanika kuantum, teori yang mendasari perilaku materi pada skala atomik.
Peran Bohr dalam Pengembangan Mekanika Kuantum
Bohr memainkan peran penting dalam pengembangan mekanika kuantum dengan mengusulkan model atomnya yang revolusioner. Model ini menggabungkan ide-ide dari teori kuantum Max Planck dan Albert Einstein untuk menjelaskan struktur atom dan emisi cahaya oleh atom. Model Bohr menentang teori fisika klasik yang mendominasi pada saat itu, yang menganggap atom sebagai bola padat yang tak terbagi.
Model atom Bohr menggambarkan atom sebagai inti positif yang dikelilingi oleh elektron yang bergerak dalam orbit tertentu. Bohr mengusulkan bahwa elektron hanya dapat berada dalam orbit-orbit tertentu dengan tingkat energi yang diskrit. Ketika elektron berpindah dari orbit dengan energi tinggi ke orbit dengan energi rendah, ia memancarkan foton cahaya dengan energi yang sesuai dengan perbedaan energi antara kedua orbit tersebut.
Model ini berhasil menjelaskan spektrum emisi atom hidrogen, yang tidak dapat dijelaskan oleh teori klasik.
Prinsip-Prinsip Utama dalam Mekanika Kuantum
Pengembangan model atom Bohr membawa beberapa prinsip kunci dalam mekanika kuantum, yang kemudian menjadi fondasi teori ini:
- Kuantisasi Energi: Bohr mengusulkan bahwa energi elektron dalam atom tidak kontinu, tetapi terkuantisasi, artinya hanya dapat mengambil nilai-nilai tertentu yang diskrit.
- Hipotesis Bohr: Bohr mengemukakan bahwa elektron dalam atom dapat berpindah dari satu orbit ke orbit lain dengan menyerap atau memancarkan foton cahaya dengan energi yang sesuai dengan perbedaan energi antara kedua orbit tersebut.
- Prinsip Korrespondensi: Bohr menunjukkan bahwa teori kuantum harus sesuai dengan teori klasik dalam batas-batas tertentu. Dalam kasus model atom Bohr, ketika bilangan kuantum yang menggambarkan orbit elektron menjadi sangat besar, perilaku atom harus sesuai dengan prediksi teori klasik.
Prinsip Kecocokan Bohr
Prinsip kecocokan Bohr merupakan konsep penting yang menghubungkan mekanika klasik dengan mekanika kuantum. Prinsip ini menyatakan bahwa dalam batas-batas tertentu, prediksi mekanika kuantum harus sesuai dengan prediksi mekanika klasik. Misalnya, ketika bilangan kuantum yang menggambarkan orbit elektron dalam atom menjadi sangat besar, perilaku atom harus sesuai dengan prediksi teori klasik.
Prinsip ini membantu menjelaskan mengapa teori klasik masih berlaku untuk sistem makroskopik, di mana bilangan kuantum sangat besar. Prinsip kecocokan Bohr merupakan jembatan penting antara dunia klasik dan dunia kuantum.
Kontribusi Bohr dalam Pengembangan Teori Atom dan Fisika Nuklir
Kontribusi Bohr tidak berhenti pada model atomnya. Ia juga berperan penting dalam pengembangan teori atom dan fisika nuklir.
- Model Atom Bohr: Model atom Bohr menjadi dasar bagi model atom modern, yang memperhitungkan sifat gelombang elektron dan prinsip ketidakpastian Heisenberg. Model atom Bohr menjadi titik awal dalam pemahaman kita tentang struktur atom dan perilaku elektron dalam atom.
- Interpretasi Copenhagen: Bersama dengan Werner Heisenberg dan lainnya, Bohr mengembangkan interpretasi Copenhagen mekanika kuantum, yang menyatakan bahwa sifat kuantum seperti momentum dan posisi elektron tidak dapat ditentukan secara bersamaan dengan ketepatan mutlak. Interpretasi ini menentang pandangan deterministik fisika klasik dan menjadi dasar bagi interpretasi mekanika kuantum yang dominan hingga saat ini.
- Teori Fisika Nuklir: Bohr juga membuat kontribusi penting dalam pengembangan fisika nuklir. Ia mengusulkan model tetesan cairan untuk menjelaskan struktur inti atom, yang menggambarkan inti atom sebagai tetesan cairan yang dapat terdistorsi dan bergetar. Model ini berhasil menjelaskan banyak fenomena nuklir, seperti fisi nuklir.
Penghargaan dan Pengakuan
Prestasi Niels Bohr dalam dunia fisika tidak hanya diakui oleh komunitas ilmiah, tetapi juga diabadikan melalui berbagai penghargaan bergengsi dan pengakuan yang luar biasa. Karya-karyanya yang inovatif dan pemikirannya yang mendalam telah memberikan kontribusi yang signifikan terhadap pemahaman kita tentang alam semesta.
Penghargaan Nobel Fisika
Puncak dari penghargaan yang diterima Bohr adalah penghargaan Nobel Fisika pada tahun 1922. Penghargaan ini diberikan kepadanya atas jasanya dalam penyelidikan struktur atom dan radiasi yang dipancarkan darinya. Teori atom Bohr, yang mengusulkan bahwa elektron bergerak dalam orbit diskrit di sekitar inti atom, telah merevolusi pemahaman kita tentang atom dan menjadi dasar bagi perkembangan mekanika kuantum.
Institut Fisika Teoritis di Copenhagen
Pada tahun 1920, Bohr mendirikan Institut Fisika Teoritis di Copenhagen, Denmark. Institut ini menjadi pusat kegiatan ilmiah dan tempat berkumpulnya para fisikawan terkemuka dari seluruh dunia. Di sini, Bohr dan rekan-rekannya mengembangkan dan memperdalam pemahaman tentang mekanika kuantum, teori atom, dan fisika nuklir. Institut ini menjadi tempat diskusi dan kolaborasi yang sangat penting dalam pengembangan fisika modern.
Pengaruh Bohr terhadap Perkembangan Fisika
Pengaruh Bohr terhadap perkembangan fisika sangat besar. Ia tidak hanya seorang ilmuwan brilian, tetapi juga seorang pemimpin yang inspiratif dan pembimbing yang berpengaruh. Melalui seminar dan diskusi yang diselenggarakan di institutnya, Bohr menciptakan lingkungan intelektual yang merangsang pemikiran kritis dan inovasi. Gagasan-gagasannya tentang komplementaritas dan interpretasi Copenhagen dari mekanika kuantum telah membentuk jalan pemikiran para fisikawan selama beberapa generasi.
“Tujuan ilmu pengetahuan bukanlah untuk menemukan jawaban yang pasti, melainkan untuk membuat pertanyaan yang lebih tepat.”
Niels Bohr
Warisan Niels Bohr: Biografi Niels Bohr 1885 1962
Niels Bohr, seorang fisikawan Denmark yang terkenal dengan kontribusinya yang luar biasa dalam fisika kuantum, tidak hanya meninggalkan jejak di dunia ilmu pengetahuan, tetapi juga membentuk jalannya perkembangan ilmu pengetahuan modern. Pemikirannya yang inovatif, terutama konsep komplementaritas, telah menjadi pondasi bagi pemahaman kita tentang alam semesta dan melahirkan berbagai penemuan ilmiah penting.
Pengaruh Pemikiran Bohr terhadap Perkembangan Ilmu Pengetahuan Modern
Kontribusi Bohr terhadap ilmu pengetahuan modern sangatlah luas dan mendalam. Ia berperan penting dalam merumuskan model atom Bohr, yang menggambarkan struktur atom dengan elektron yang mengorbit inti atom pada tingkat energi tertentu. Model ini menjadi dasar bagi perkembangan kimia kuantum dan fisika atom, membuka jalan bagi pemahaman yang lebih dalam tentang perilaku atom dan molekul.
Konsep Komplementaritas dalam Fisika Kontemporer
Konsep komplementaritas Bohr menyatakan bahwa sifat-sifat gelombang dan partikel cahaya dapat muncul secara bersamaan, meskipun saling eksklusif. Ini adalah konsep yang revolusioner yang mengubah cara kita memahami sifat cahaya dan materi. Konsep ini terus relevan dalam fisika kontemporer, terutama dalam bidang mekanika kuantum dan fisika partikel, di mana sifat dualitas gelombang-partikel menjadi sangat penting.
Tokoh-tokoh Penting dalam Fisika yang Terinspirasi oleh Karya Bohr
Karya Bohr telah menginspirasi banyak fisikawan terkemuka di dunia, yang meneruskan warisannya dan mengembangkan pemahaman kita tentang alam semesta. Beberapa tokoh penting yang terinspirasi oleh karya Bohr antara lain:
- Werner Heisenberg: Salah satu pendiri mekanika kuantum, yang mengembangkan prinsip ketidakpastian Heisenberg, yang erat kaitannya dengan konsep komplementaritas Bohr.
- Wolfgang Pauli: Fisikawan Austria yang dikenal karena prinsip eksklusi Pauli, yang menyatakan bahwa dua elektron tidak dapat memiliki keadaan kuantum yang sama dalam atom.
- Paul Dirac: Fisikawan Inggris yang mengembangkan persamaan Dirac, yang menjelaskan perilaku elektron dan antimateri, dan juga berperan penting dalam pengembangan elektrodinamika kuantum.
Peran Bohr dalam Pengembangan Program Penelitian Nuklir
Bohr juga memainkan peran penting dalam pengembangan program penelitian nuklir selama Perang Dunia II. Ia bekerja di Proyek Manhattan, program rahasia yang bertujuan untuk mengembangkan bom atom. Ia menyuarakan keprihatinannya tentang potensi bahaya senjata nuklir dan menekankan pentingnya kerja sama internasional dalam mengendalikan teknologi nuklir.
Warisan Niels Bohr melampaui batas waktu dan ruang. Pemikirannya yang mendalam tentang komplementaritas, tentang bagaimana dua konsep yang tampak bertentangan dapat saling melengkapi, masih relevan dalam fisika kontemporer. Institut Fisika Teoritis di Copenhagen, yang didirikannya, menjadi pusat pertukaran ide dan penelitian ilmiah, melahirkan generasi baru fisikawan yang meneruskan tongkat estafet pengetahuan. Kisah Niels Bohr mengingatkan kita bahwa ilmu pengetahuan bukanlah sekadar kumpulan fakta, melainkan sebuah petualangan tanpa henti dalam mencari makna dan kebenaran.
